备受争议的新冠人体挑战试验,科学界为何有支持者
2021-02-26
新冠病毒“人体挑战试验”是否该启动?这一复杂话题早在2020年上半年就被提出并引起广泛讨论。近一年之后,英国成为率先公布将开启这一争议试验的国家。
英国政府在一份声明中称,这一试验将在1个月内进行,由英国政府疫苗工作组、伦敦帝国理工学院、伦敦皇家自由NHS信托基金会和领先的临床公司 hVIVO合作进行, hVIVO公司是病毒人类挑战模型的先驱。初步研究将使用最初未变异的新冠病毒对健康志愿者进行攻毒试验,研究病毒对人的早期感染机制,包括确定能够引起感染所需的最小的病毒剂量和影响病毒传播的因素,以及分析症状出现之前人体早期的免疫反应。
上述初步研究展开后,英国的这项人体挑战试验还计划在后期为健康志愿者提前提供在临床上已证明安全性的候选新冠疫苗,然后再将志愿者暴露于病毒中,从而帮助评估最有效的疫苗并加速疫苗开发。
消息公布后,人体挑战试验的支持者和反对者再度活跃在各大媒体。支持者们认为,这类试验此前在霍乱、流感、疟疾等疾病方面作出重要贡献,在新冠病毒上展开也同样是安全和合乎道德地进行的。重要的是,相比于让每款候选疫苗去进行大规模、耗巨资的三期临床试验,人体挑战试验可以帮助快速地识别有效疫苗的潜力。
但反对者对这些研究的安全性、价值、伦理等提出了质疑。他们尤其指出,在目前全球已有数款疫苗推出的前提下,人体挑战试验是否还如此必要?
香港大学李嘉诚医学院艾滋病研究所所长陈志伟在接受澎湃新闻(www.thepaper.cn)记者采访时表示,“我不完全认同人体挑战试验,关键有无这样试验的必要性。”他认为,如果自然流行过程中可以评估疫苗的有效性,则没有必要人体挑战试验。
陈志伟同时提醒,无症状感染对疫苗受试者的伤害也是要关注的问题。“因为疫苗受试者成了无症状感染者,也可以成为传染源,把疫苗受试者隔离起来很久,不知是否实际可行。”此外,在目前的研究认识下,病情轻微并不代表着感染者受影响小。“研究发现,新冠的无症状感染对上呼吸道细胞、神经细胞是有伤害的,对免疫系统的抑制也是有的。”
他呼吁,新冠人体挑战试验应“尊重科学,防止臆断;信息透明,安全第一。”
世卫新冠病毒人体挑战试验指导意见工作组成员、加拿大西安大略大学生命伦理学家查尔斯·韦耶尔(Charles Weijer)此前对澎湃新闻(www.thepaper.cn)记者表示,作为一个生物伦理学家,他从伦理基础的角度反对这类研究。
英国新冠人体挑战试验团队首席研究员、英国帝国理工学院传染病学系临床教授邱克让(Chris Chiu)此前则对澎湃新闻(www.thepaper.cn)表示,新冠病毒“人体挑战试验”目前还在寻找志愿者的阶段,志愿者将经过仔细筛选,以确保他们感染病毒后发展成重症的风险最低,预计在2021年3月初选出第一批试验参与者。试验将“缓慢且小心”地开始,持续时长取决于“引起大多数参与者感染所需的病毒剂量”。“如果引发感染所需的病毒剂量非常低,这项研究大约需要3个月的时间。”
如何减轻试验风险、确保参与者的健康与生命安全?邱克表示,他们将在18岁-30岁的健康年轻人中仔细筛选志愿者,确保他们没有其他疾病或者引发严重感染的风险因素。“有很多数据告诉我们,这个年龄组的新冠肺炎患者很少发展成重症。”
在争议面前,我们不妨回到人体挑战试验本身。200多年前,人体挑战试验被首次记录下来,而在近几十年来,其已在越来越多的疾病中被启用。此外,在新发传染病频发的新形势下,科学界又如何考量这一手段?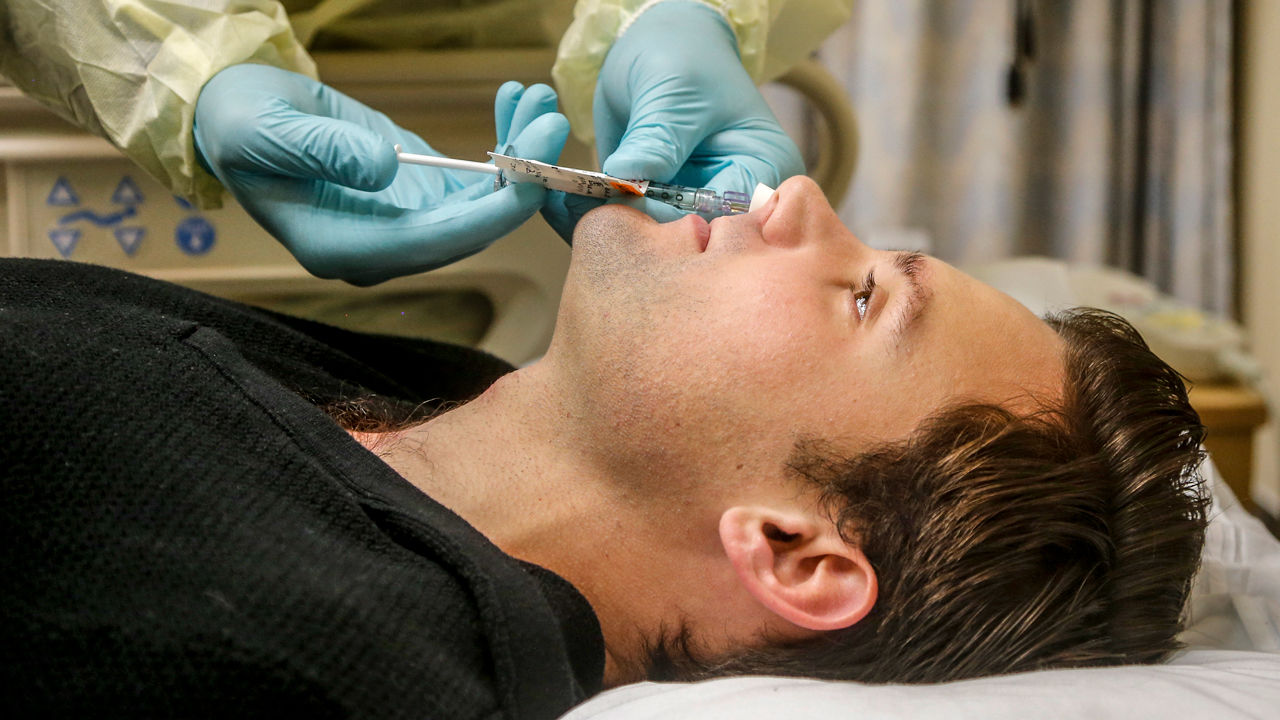 200多年前被首次记录
200多年前被首次记录
小鼠、猕猴,这两种动物大家都不陌生,它们在人类医学发展史上贡献巨大。在此次COVID-19大流行中也不例外,在各种各样的研究论文中都能看到它们的身影,它们被攻毒,然后观察和记录各项指标。其中有一部分还最终被处以安乐死提供病理数据。
相比于用动物去“试毒”,人类挑战试验(HCTs)在现代医学中并非是完全“上不了台面”的手段。2020年5月7日,世界卫生组织(WHO)正式发布了一份COVID-19人类挑战试验的指南,强调必须按照“最高的科学和伦理”标准开展新冠疫苗“人体挑战试验”,至少须遵守8项伦理准则。
包括试验要有强有力的科学依据,以公众、相关专家和决策者共同参与协商的方式获得信息,研究者、出资方、决策者和监管机构之间密切协调,确保受试者筛选标准能限制并最小化试验风险,须经过独立委员会审查以及履行严格的知情同意程序等。
在诸多框架的背后,是这种手段的争议长期存在。人类挑战试验也称为受控的人类感染模型(CHIMs),顾名思义,就是研究人员故意让人类参与者暴露接触疾病。从公开进行的试验来看,其主要目的是更多地了解疾病的早期阶段、传播,或加速疫苗等干预措施的测试。
1796年5月14日,英国的爱德华·詹纳(Edward Jenner)对天花进行了第一次有记录的人体挑战试验研究。也就是从那时候起,这类研究的用处就开始无法被忽视。1798年,詹纳非正式发表了《天花疫苗的因果之调查》,公布了23个种痘而不患天花的病例,由此用牛痘预防天花的方法逐渐被接受并得到越来越广泛的应用。
20世纪初也出现过人体挑战试验方面的典型例子。美国陆军医生沃尔特·里德(Walter Reed)在1901年领导的研究小组通过让感染蚊子叮咬志愿者的试验证实了古巴医生Carlos Finlay的理论,即黄热病是由一种特定的蚊子传播的,而不是通过直接接触。
而就在英国,在距离詹纳首次人体挑战试验一个多世纪后的1931年,英国病理学家、细菌学家Frederick William Andrewes从美国返回,他当时已经观察到用黑猩猩来研究流感。但他回到英国后开展类似工作的资金不足,因此从伦敦圣巴塞洛缪医院(St Bartholomew’s Hospital)招募学生。他解释称,退而求其次的选择是这些学生,因为“他们比黑猩猩更便宜”。
另外值得一提的是,第二次世界大战结束后,美国军队从英国撤退时把美国红十字会“哈佛医院”的战地部队留在了索尔兹伯里平原。从1946年起,该医院成为由大卫·蒂勒尔(David Tyrell)领导的普通感冒科(CCU),志愿者们通过向鼻子中注入少量病毒来进行接种。CCU将健康的志愿者安置在与他人相对隔离的环境中,从而降低了接触社区获得的感染源或将病毒传染给公众的风险。该部门最终于1989年关闭;在近40年的研究中,它招募了2万名志愿者。其研究有助于更好地了解呼吸道病毒、病毒生命周期、可能的疫苗以及首个获批的抗流感化合物金刚烷胺。
hVIVO公司的研究团队在2018年发表于《Respiratory Research》的一篇综述文章写道,CCU关闭后,美国则继续进行实验性感染研究,使用小型汽车旅馆和旅馆取代索尔兹伯里平原上的隔离屋。作者们认为,这些研究促成了20世纪90年代新型NA抑制剂的重大发展,包括吸入药物扎那米韦(zanamivir)和口服药物奥司他韦(oseltamivir)。
阴影和波折
在过去的70年时间里,全球科学家用人类挑战试验研究了大约15种主要病原体,涉及近3万名患者,公开信息中显示没有发生严重的不良反应。这些试验对霍乱、伤寒、登革热、流感和其他疾病的治疗和疫苗开发做出了重大贡献。
尽管如此,但部分研究仍饱受争议,甚至有些“在伦理上是不允许的”,科学家们也不会总是满足于在低风险的疾病中尝试。
2011年,一项臭名昭著的人体挑战试验即被揭露。当年的8月底,美国生物伦理问题研究总统委员会公布的一份报告显示,上世纪40年代,在美国政府出资对盘尼西林(即青霉素)作用进行研究的项目中,美国研究人员明知违反伦理标准,仍故意使危地马拉1300多名囚犯和精神病患者感染上梅毒等性病。
2011年10月1日,时任美国国务卿希拉里、卫生和公众服务部长凯瑟琳·西贝利厄斯发表联合声明,向危地马拉性病实验的受害者致歉。
除了上述这样“在伦理上是不允许的”,重要的伦理准则还禁止对可能导致严重发病率或死亡率且尚未证明有效治疗的疾病,如埃博拉或炭疽,进行人体挑战试验。
不过,在实际的伦理审批中,情况可能更加复杂,通常采用“一事一议”来谨慎、全面平衡人体挑战试验的“风险”和“获益”。
近年来一个典型的例子是寨卡病毒 (Zika virus) 。寨卡病毒和黄热病毒、登革热病毒、日本脑炎病毒和西尼罗病毒等都属于蚊媒传播的黄病毒属病毒。早在1947 年,科学家就分离到病毒,但寨卡病毒之前并没有引起太多的关注,原因在于发病症状较轻微,且分布区域有限。
但进入21世纪以来,寨卡病毒传播激增。2015 年12 月,世卫组织基于埃博拉疫情应对的教训,组织专家讨论最需加强应对研发的病原体清单,确定了8 种最危险病原体及3种次危险病原体,其中寨卡病毒为3 种次危险病原体之一。2016 年2 月1 日,世卫组织宣布寨卡病毒为全球紧急公共卫生事件。
目前的研究表明,寨卡病毒在绝大多数感染者中是无症状的,大多数有症状的病例都是轻微和短暂的,但它可能会带来潜在的毁灭性后果。在成人中,寨卡病毒可引起神经系统并发症,包括但不限于格林-巴利综合征,这是一种可导致瘫痪的急性进行性神经病变。它也可导致成人心脏并发症。最令人担忧的是,寨卡病毒从孕妇传播给胎儿可能会导致先天性寨卡综合症,通常包括小头畸形以及神经发育、视力损害、心脏缺陷和其他并发症等潜在的显著异常。
2016年,有研究人员提议进行人体挑战试验,让健康的志愿者故意接触寨卡病毒。该试验目的是为了更多地了解寨卡病毒感染的早期阶段,并有效地测试疫苗是否能够预防寨卡病毒感染。试验当时计划在美国进行,招募健康的志愿者,参与者将在诊所内隔离约两周。
作为这项试验的潜在资助方,美国国家过敏和传染病研究所和沃尔特·里德陆军研究所担心寨卡病毒人体挑战试验在伦理上很复杂。因此,他们组建了一个独立的、多学科的专家小组,来解该人体挑战试验是否在伦理上是合理的问题。
经过广泛的审议后,委员会起草了一份报告,并于2017年2月发布。寨卡病毒人体挑战试验伦理专家小组为提供了一个初步的伦理框架,并得出结论:寨卡病毒人体挑战试验在原则上可以在伦理上得到证明,但在当时还不成熟。
专家组得出寨卡病毒人体挑战试验不成熟的结论,主要有两个原因:第一、未同意参与研究的旁观者存在潜在风险,而且他们对寨卡病毒传播的了解不够,无法确保他们受到保护;第二、现有的研究仍在进行中,专家组不确定是否需要寨卡病毒人体挑战试验来加速疫苗开发进程。
进一步解释来说,首先,尽管寨卡病毒对大多数感染者来说似乎是无症状的,但胎儿接触寨卡病毒可能是灾难性的。在该小组进行审查时,尚不清楚参与者可能会在多长时间内通过性传播给他人。较高的估计是,参与者可能在6个月内具有传染性,这也使得很难确保采取足够的预防措施来避免传染给胎儿。其次,由于正在进行的研究已经产生了关于疫苗安全性和有效性的信息,所以当时还不清楚寨卡病毒人体挑战试验是否提供了足够的社会效益来证明风险的合理性。
有研究人员在2019年专门以这次寨卡病毒人体挑战试验的搁置发表了一篇论文,以此案例为教训,探讨什么时候人类挑战试验可以用于对抗新发传染病。
研究人员在这篇论文中指出,值得注意的是,自专家组提交建议以来,外部条件、有关寨卡病毒的现有证据以及寨卡病毒的流行病学都发生了变化。对于感染寨卡病毒的人来说,他们的感染期是众所周知的,在病毒载量不高的人身上,寨卡病毒可以传播大约30天(而不是之前建议的6个月,寨卡病毒感染者应该避免无保护的性行为)。此外,尽管寨卡病毒疫苗II期试验正在进行,但参与人数低于预期,III期试验的有效性似乎不可行,一些药物和疫苗开发商已经停止了寨卡病毒的研究。
他们认为,“这表明,如果在今天进行,寨卡病毒人体挑战试验可能有明确和相当大的价值,前提是对涉及的伦理考虑和保护旁观者和研究参与者的计划进行独立、严格的审查。
值得注意的是,支持人体挑战试验的科学家并不在少数。他们指出,尤其在过去的20年里,人类挑战试验的技术和监管的严密性得到了改进,只要受试者是健康、知情和自由参与的,并且按照既定的做法进行测试,现在被普遍认为该方法是科学有效的和道德上适当的。
COVID-19人体挑战试验?
在全面蔓延的COVID-19大流行面前,人体挑战试验这一大胆设想早就被一些科学家提出。
2020年3月,美国罗格斯大学、哈佛大学公共卫生学院和英国伦敦卫生与热带医学学院等团队的研究人员就发表了一篇论文,题为“Human Challenge Studies to Accelerate Coronavirus Vaccine Licensure”。Nir Eyal等人在这篇论文中指出,SARS-CoV-2候选疫苗的受控人体挑战试验可加速有效疫苗的测试和潜在推广。Nir Eyal等人认为,通过替代传统的候选疫苗三期临床试验,这种试验可能会减少许多个月的许可过程,使有效疫苗更快地获得。
他们也同样提到,显然,用这种活病毒挑战志愿者有引发严重疾病甚至死亡的风险。然而,他们认为,通过加速疫苗评估,此类研究可以减轻冠状病毒相关死亡率和发病率的全球负担。此类研究中的志愿者自主授权风险,如果参与者是健康的年轻成年人,他们的净风险可以接受的。
Nir Eyal等人当时在论文中指出,一种新型的冠状病毒迫使我们考虑非传统的方法。“这种方法并非没有风险,但疫苗推出每推迟一周,都将会导致全球数千人死亡。重要的是,人体挑战试验是在志愿者知情同意、研究风险最小化以及受试者基线感染风险(在正常生活中感染风险)较高的背景下实施的。”
他们认为,作为应急响应的需要,它不侵犯受试者个人权益,而是兼顾个人权益和全球公共卫生紧急状况后做出的选择。
他们当时提到,目前评估COVID-19疫苗疗效的计划是通过较慢的三期临床试验。提出和实施人类挑战试验也需要一些时间,他们并不建议在此期间必须暂停任何为三期临床试验准备的疫苗开发。“然而,我们相信,在大多数疫苗准备好进行有效性测试之前,可以开展挑战性研究。”
Nir Eyal等人在论文总结中强调,为进一步评估潜在的人类挑战试验,他们建议召集一个专家小组,成员包括那些有其他病原体的人类挑战研究经验的人、监管机构、疫苗试验专家、伦理学家、潜在参与者和相关资助机构,以规划此类研究是否以及如何符合伦理地迅速推进。
2020年6月,新加坡国立大学、牛津大学等团队的研究人员也发表了一篇文章,题为“COVID-19 Vaccine Development: Time to Consider SARS-CoV-2 Challenge Studies?”。文章当时写道,在全世界努力控制COVID-19大流行之际,一些研究人员最近提出了一项大胆的议程:利用“挑战研究”开发疫苗。他们的想法是故意感染个体,以便加速最终获得有效疫苗的许可。
G.O. Schaefer等人认为,尽管需要进一步的分析来确定这样的研究是否在科学和伦理上是合理的,但这一选择至少应该被“摆到桌面上”。如果抗击新冠肺炎的努力类似于一场战争,而且很可能是一场旷日持久的战争,那么我们应该仔细考虑应该部署哪些“武器”。
作者们显然是支持人类挑战试验的,他们称,一些人将挑战研究描述为放松或降低研究标准。“但恰恰相反,当这些研究设计良好并遵循既定的挑战研究程序时,它们对参与者来说是合乎道德和安全的。”
Schaefer等人也提到,任何挑战研究最直接的担忧是对参与者和更广泛的社会的重大风险。COVID-19的死亡率和严重并发症的估计数各不相同,但研究显示有明显的年龄差异,年轻人的死亡率明显较低。因此,挑战研究都可能招募更年轻的个体,以最大程度降低SARS-CoV-2挑战的不良后果风险。
而一个不利的因素是,对年轻健康成年人的结果可能不会推广到老年人和那些从有效疫苗中获益最多的基础病患者中。但作者们仍然认为,这种方法可以加速有希望的候选疫苗进入三期临床试验的进程,这些试验将纳入高危人群。
Schaefer等人更是直白地提出:我们应该允许个人承担多大的风险?“以战争时期来类比意味深长,如果个人可以自愿冒着生命危险奔赴战场,为什么不允许他们在全球抗击新冠肺炎疫情中这样做?”
值得一提的是,在此前近一年的讨论中,虽然有其他研究目的,但加快疫苗开发是提及最多的。在英国公布将正式开展首个新冠人体挑战试验的当下,情况已今非昔比。在讨论初期,全球新冠的治疗药物和疫苗开发尚处于早期,眼下则已有多款疫苗被批准使用。
类比上述提到的寨卡病毒人体挑战试验的“不成熟”,此时启动新冠人体挑战试验是否更具有合理性?从目前的争议来看,显然科学界也未达成一致。
2020年10月,约翰斯·霍布金斯大学、马里兰大学、华盛顿大学等团队的研究人员在《美国国家科学院院刊》(PNAS)发表了一篇评论文章,题为“For now, it’s unethical to use human challenge studies for SARS-CoV-2 vaccine development”。
Jeffrey P. Kahn等人当时写道,对新冠疫苗的渴望是可以理解的,这导致了外界对人类挑战研究可能性的重大讨论,甚至已经有了一些计划,以作为加速识别、测试和开发有效疫苗的工具。
他们提到,通常情况下,在疫苗开发中采用人体挑战研究要求将引入挑战的疾病要么有可用的挽救疗法来治疗被感染的人,要么已知该疾病具有自限。但SARS-CoV-2感染目前还没有挽救疗法。
Jeffrey P. Kahn等人在文章中明确表示不同意新冠病毒人类挑战试验。“我们认为,目前继续进行此类试验是不道德的。尽管这些研究的支持者表示,这些研究将加快批准疫苗的时间,但事实并不能支持这些说法。人类挑战试验面临着不可接受的伦理挑战,而且,采取这些措施会损害公众在等待疫苗开发过程本身就已经脆弱的信心,从而损害公众利益。”
他们总结指出,鉴于COVID-19的严重性,以及缺乏治愈或有效治疗方法,目前在研发SARS-CoV-2疫苗时采用人体挑战试验是不道德的。“我们认为支持者关于加速疫苗开发的核心主张是有缺陷的,而且我们认为,这类试验的风险-利益平衡太不确定,而且可能是不可接受的,即使有更多的信息。”
 200多年前被首次记录
200多年前被首次记录
爱德华·詹纳(Edward Jenner)用牛痘预防天花,他也被公认为免疫学之父。
值得注意的是,詹纳的贡献不仅仅在于发现牛痘接种能提供免疫保护而不致病,更在于不局限于民间说法,而是通过试验证明接种牛痘后再人为地让受试者感染天花病毒但不会致病。他将这个操作过程成为“接种疫苗”,第一次确立“疫苗免疫”的概念,詹纳由此开创了近代免疫学先河,被公认为“免疫学之父”。
英国病理学家、细菌学家Frederick William Andrewes
超过100名学生立即参与了这项研究,但在后续的研究时并没有像黑猩猩那样被隔离起来。正因如此,观察到的症状可能不是由挑战病毒引起的,而是由社区中其他的呼吸道感染引起的,因此这项研究结果陷入困惑。一年后,英国医学研究委员会(MRC)终止了这项研究。
美国研究人员使危地马拉1300多名囚犯和精神病患者感染上梅毒等性病。
在1300多名感染者中,仅有700人获得了某种形式的治疗。1946至1948年,共有5500名危地马拉人参加了这项实验。截至1953年底,这5500名实验参与者中则至少有83人死亡。上一篇:有机硅:凸显“中国时代”特征









